1. Donner le nom de l’électrode (anode ou cathode) au niveau de laquelle se forme le dibrome. C’est l’anode (qui attire l’anion Br−)
2. Ecrire les équations des réactions aux électrodes, ainsi que l’équation bilan lors de l’électrolyse.
- Au niveau de la cathode : Pb(aq)2++2e−⇄Pb(s)
- Au niveau de l’anode : 2. Br(aq)−⇄Br2(g)+2e−
- Equation bilan : Pb(aq)2++2.Br(aq)−⇄Pb(s)+Br2(g)
3. Déterminer la valeur de l’intensité I du courant électrique passant dans le circuit pendant la durée Δt.

On sait que I= Dureˊe du temps Quantiteˊ d’eˊlectriciteˊ =ΔtQ
Avec Q=n(e−)×F
Et d’après le tableau d’avancement, n(e−)=2x et x=nt(Pb)=M(Pb)m
Combinant ces relations, on aboutit à l’expression :
I=M(Pb)⋅Δt 2. m⋅F=207,2×36002×20,72×9,56.104=5,36A
4. Calculer, dans les conditions de l’expérience, le volume V du gaz dibrome formé pendant Δt.
Le tableau d’avancement :
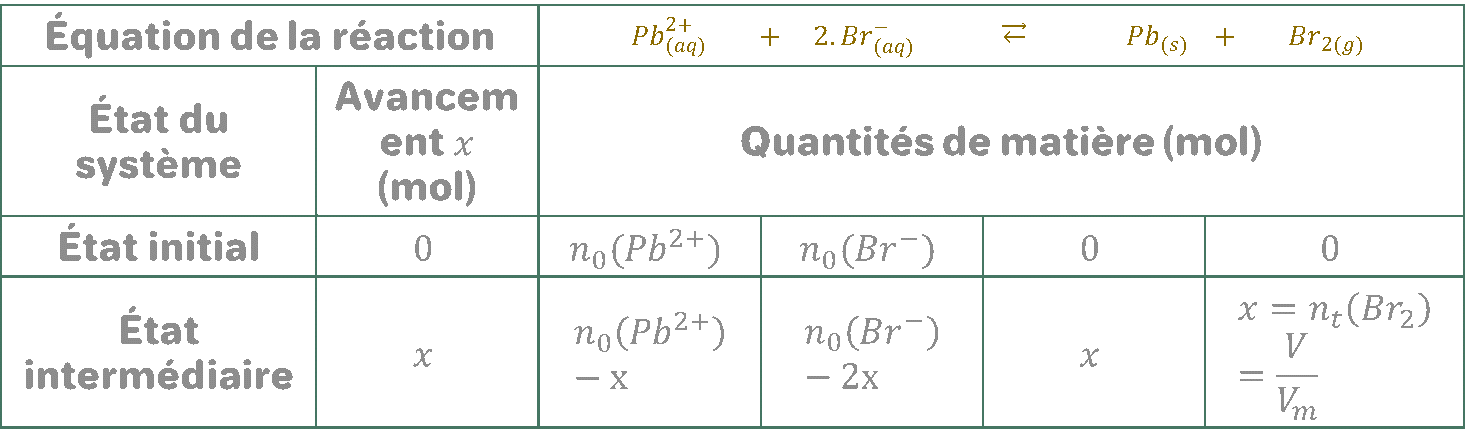
D’après les deux tableaux : x=M(Pb)m et x=nt(Br2)=VmV
On déduit que : V=M(Pb)m⋅Vm=207,220,72×70,5=7,05L