CHIMIE
Partie I
1- Solution aqueuse d'hydroxyde de sodium:
- Expression du pH :
On a : Ke=[H3O+]×[HO−]
Soit : [H3O+]=[HO−]Ke=CBKe
Et: pH=−log[H3O+]=−logCBKe
Donc: pH=−logKe+logCB
1.2 - Valeur de CB.
On a : pH=−logCBKe
Donc : 10−pH=CBKe
Soit : CB=10−pHKe=Ke×10pH
Application numérique :
CB=10−14×1012,7=5×10−2 mol.L−1
2. Contrôle de la qualité d'un lait de vache :
2.1- Équation de réaction de dosage :
HA(aq) +HO(aq )−⟶A(aq )−+H2O(ℓ)
2.2- Expression de CA :
* Tableau d'avancement :
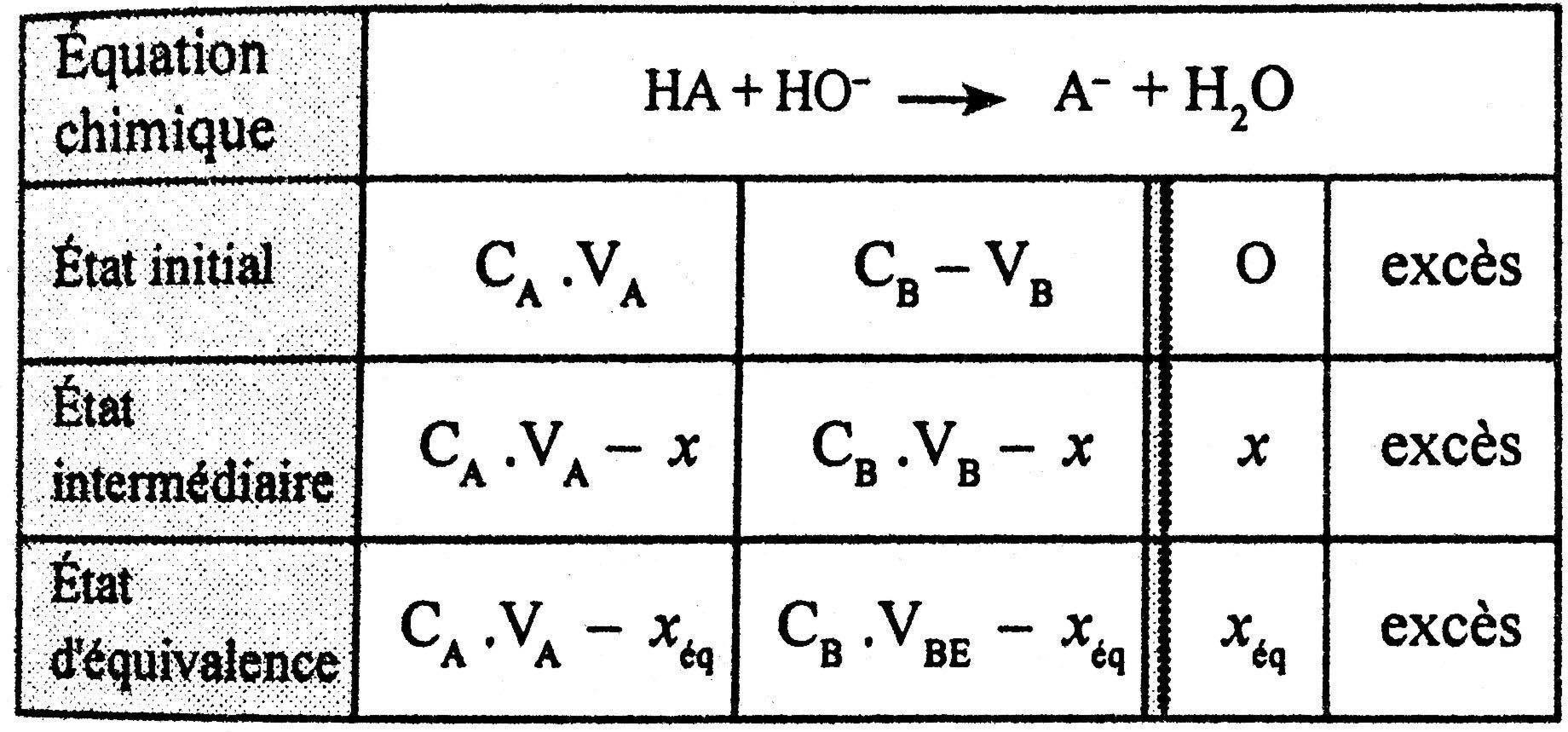
A l'équivalence ; les deux réactifs sont totalement consommés ;
donc: CA⋅VA−xeˊq=0
soit : xeˊq=CA⋅VA
CB⋅VBE−xeˊq=0 soit : xeˊq=CB⋅VBE
Donc : CA⋅VA=CB⋅VBE
Soit : CA=VACB⋅VBE
2.2- On a la relation:
KA=[AH][A−]×[H3O+] soit : [A−]×[H3O+]=KA⋅[AH]
D'après le tableau d'avancement précèdent :
On a : [A−]= VA+VBx et [AH]= VA+VBCA⋅VA−x
D'où : VA+VBx×10pH=KA⋅( VA+VBCA⋅VA−x)
Donc : x×10pH=KA(CA⋅VA−x)
Avec : CA⋅VA=CB⋅VBE
Et pour : 0<VB<VBE on est avant l'équivalence donc HO− est le réactif limitant: CB⋅VB−x=0 soit : x=CB⋅VB
Ainsi : CB×VB×10−pH=KA⋅(CA⋅VBE−CB⋅VB)
Soit: CB×VB×10−pH=KA⋅(VBE−VB)⋅CB
Donc: VB⋅10−pH=KA⋅(VBE−VB)
2.4- Étude graphique :
2.4.1- * Volume VBE :
D'après le tableau d'avancement précèdent (VB⋅10−pH) s'annule pour VB=VBE
Et graphiquement (10−PH×VB) s'annule lorsque la courbe coupe l'axe des abscisses .
C'est -à-dire pour : VBE=VB=12,4 mL.
* Concentration CA :
On a: CA=VACB×VBE=255×10−2×12,4
Soit : CA=2,48×10−2moℓ⋅L−1
2.4.2- Valeur de pKA :
D'après l'équation de la droite affine ; la valeur (KA×VB) est le point d'intersection de la droite avec l'axe des ordonnées :
Soit : KA×VBE=15,5×10−4 mL
D'où : KA= VBE15,5×10−4=12,415,5×10−4
Donc : KA=1,25×10−4
Et : pKA=−logKA=−log(1,25×10−4)
pKA=3,9
2.5-Qualité du lait étudié :
* Calcul de la masse de l'acide lactique dans le volume V=1 L de lait.
On a: n=CA×VA=Mm
Soit : m=CA×V×M
Donc : m=2,48×10−2×1×90=2,232 g
* Acidité de ce lait :
1∘D correspond à la masse 1×10−1 g d'acide .
Ainsi la masse m=2,232 g d'acide correspond à : 22,32∘D
Donc ce lait n'est pas frais.
Partie II : Pile chrome - argent
1-Équation de réaction :
Au pôle négatif : Cr(s)⇌Cr(aq)3++3e−
Au pôle positif : Ag(aq)+++e−⇌Ag(s)
L'équation bilan de fonctionnement de la pile :
Cr(s)+3Ag(aq)+⟶Cr(aq)3++3Ag(s)
2-Avancement de la réaction:

A l'instant t1; la quantité de matière du chrome consommée est : n(Cr)=∣n1(Cr)−ni(Cr)∣=t1
D'où : x1=M(Cr)m(Cr)=5252×10−3=10−3moℓ.
3 - Concentration des ions Cr3+ à l'instant t1:
[Cr3+]= VC1×V+x1=C1+ Vx1
[Cr3+]=0,1+0,110−3=0,11 mol⋅L−1
4- La valeur de l'instant t1 :
On a la relation: I0×Δt=n(e−)×F
Soit : Δt=I0n(e−)×F=I03⋅x⋅F
Δt=50×10−33×10−3×9,65×104=5790 S.
Avec t0=0 et Δt=t1−t0=t1=5790 S.