Règles de l'octet et du « duet »
Stabilité chimiques des gaz rares
Une entité chimique est particulièrement stable si sa couche électronique externe est saturée (pleine).
Les gaz rares (He, Ne, Ar, $$\mathrm{Kr}, \mathrm{Xe}, \mathrm{Rn}$$ ) sont les seuls éléments chimiques qui existent à l'état naturel sous forme de gaz monoatomique. Ils sont chimiquement inertes et particulièrement stables.

Doc.6 - les ballons remplis d'hélium qui s'envolent. L'hélium est un gaz plus léger que l'air et ne présente aucun danger d'inflammation.
Énoncé des règles
Règle du «duet »
Au cours de leurs transformations chimiques, les atomes de numéro atomique inférieur ou égal à 4 ($$Z \leq 4$$) évoluent de manière à avoir 2 électrons sur leur couche externe.
Règle de l'octet
Au cours de leurs transformations chimiques, les atomes de numéro atomiques supérieur ou égal à $$5(Z \geq 5)$$ évoluent de manière à avoir 8 électrons sur leur couche externe.
NB : il existe des composés stables qui ne satisfont pas la règle du " duet " ou de l'octet.
Remarque
Afin de satisfaire la règle du " duet " ou de l'octet, les atomes évoluent de 3 façons différentes :
Perdre des électrons et se transformer en cations.
Gagner des électrons et se transformer en anions.
Mettre en commun des électrons avec d'autres atomes pour former des molécules
Applications aux ions monoatomiques
Les cations et les anions monoatomiques formés pour satisfaire la règle de l'octet ou du « duet » sont plus stables que l'atome correspondant.
مثال
L'atome de sodium $$\mathrm{Na}(Z=11)$$ conduit par perte d'un électron, au cation stable $$\mathrm{Na}^{+}$$, comportant 11-1 =10 électrons. Sa structure électronique $$(\mathrm{K})^{2}(\mathrm{~L})^{8}$$ est la même que celle du Néon.
La liaison covalente
Les molécules sont des assemblages d'atomes liés par des liaisons covalentes. Pour former des liaisons covalentes, deux atomes$$A$$ et $$B$$ mettent en commun des électrons en les associant par paires ou doublets. Ces doublets d'électrons, localisés entre les deux atomes liés, sont des doublets liants. Ils sont représentés par un tiret (-) reliant les deux atomes : A-B. ce partage d'électrons stabilise chacun des atomes $$\mathrm{A}$$ et $$\mathrm{B}$$
مثال
$\mathrm{H}-\mathrm{H}$ : chaque atome d'hydrogène a pour structure électronique $(\mathrm{K})^{1}$.
Dans la molécule de dihydrogène $\mathrm{H}_{2}$, grâce à l'apport de l'autre atome, la structure effective est $(\mathrm{K})^{2}$ pour chaque atome.
$\mathrm{H}-\mathrm{Cl}$ : la structure électronique de $\mathrm{Cl}$ est $(\mathrm{K})^{2}(\mathrm{~L})^{8}(\mathrm{M})^{7}$. Dans la molécule de chlorure d'hydrogène, sa structure électronique effective devient $(K)^{2}(L)^{8}(M)^{8}$
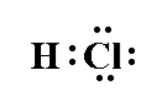
Doc.7 - mise en commun d'électrons pour former une liaison.
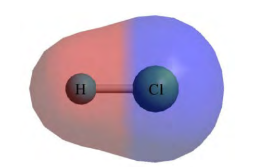
Doc.8 - la molécule de $$\mathrm{HCl}$$ selon le modèle du nuage électronique
Représentation de Lewis
Doublets non liants
Les électrons de couche externe des atomes ne sont pas forcément tous impliqués dans des liaisons covalentes. Ceux qui ne participent pas à la liaison s'assemblent par paires localisées sur les atomes appelés doublets non-liants, ils sont symbolisés par des tirets placés sur l'atome
مثال
$$\mathrm{H}_{2} \mathrm{O}$$ : sur les six électrons de couche externe de l'oxygène, deux sont impliquées dans des liaisons covalentes. Les quatre autres s'assemblent deux à deux : l'oxygène porte 2 doublets non-liants dans la molécule d'eau.
$$\mathrm{CH}_{4}$$ : dans la molécule de méthane, 8 électrons sont apportés par l'ensemble des couches externes des atomes :
4 sont apportés par les quatre atomes d'hydrogène de structure électronique $$(\mathrm{K})^{1}$$.
4 sont apportés par l'atome de carbone de structure électronique $$(\mathrm{K})^{2}(\mathrm{~L})^{4}$$.
Ces 8 électrons constituent 4 doublets liants.
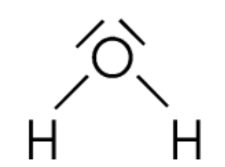
Doc.9- la représentation de Lewis de la molécule d'eau

Doc. 10 -représentation deLewis de $$\mathrm{HCl}$$
Liaisons multiples
Afin de satisfaire la règle de l'octet, certains atomes sont liés entre eux par plus d'un double liant. Ce type de liaison s'appelle une liaison multiple
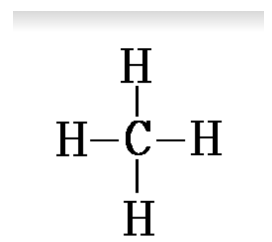
Doc.10 -représentation de Lewis de la molécule de méthane
مثال
L'éthène $$\mathrm{C}_{2} \mathrm{H}_{4}$$ : les deux atomes de carbones sont liés par deux doublets liants. La liaison ainsi formée s'appelle liaison double
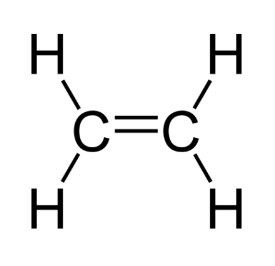

diazote
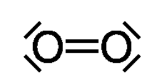
dioxygène
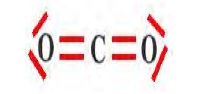
Dioxyde de carbone
Doc.11 Exemples de molécules possédant des liaisons doubles ou triples
Méthode d'écriture d'une représentation de Lewis
Pour écrire la représentation de Lewis d'une molécule à partir de sa formule brute, on procède comme suit :
- Faire la somme des nombres d'électrons $\mathrm{N}$ de la couche externe de chacun des atomes après avoir écrit la structure électronique ;
- Diviser $$\mathrm{N}$$ par deux pour obtenir le nombre de doublets de la molécule ;
- Répartir ces doublets autour des atomes :
- Avec des doublets liants autour des atomes,
- Avec des doublets non-liants appartenant à un seul atome.
- Vérifier que chaque atome respecte la règle de l'octet en s'entourant de quatre doublets ( les atomes d'hydrogène doivent respecter la règle du « duet » et ne partager qu'un seul doublet)
Notion d'isomérie
لمواصلة هذا الملخص، قم بالتسجيل بالمجان في كيزاكو

- ملخصات الدروس غير محدودة
- فيديو مجاني في كل درس
- تمرين مصحح مجاني
- اختبار تفاعلي