La composition de l'atome
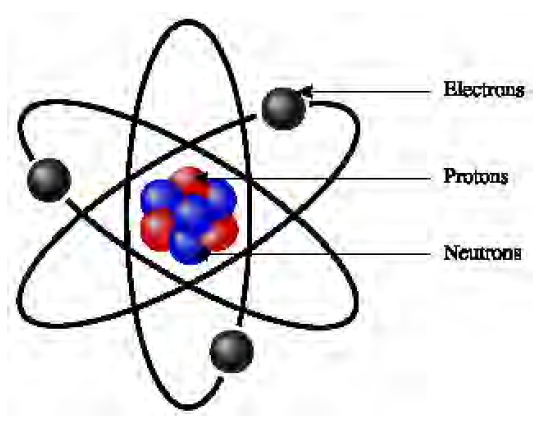
L'atome est constitué d'un noyau et d'électron gravitant autour de ce noyau
Doc.1 - modèle d'un atome
Le noyau atomique
Le noyau est constitué de particules appelés nucléons. II existe deux types de nucléons : les protons chargés positivement et les neutrons électriquement neutres
Notation symbolique
Le noyau atomique est représenté symboliquement par la notation :
$${ }_{Z}^{A} X$$
X : symbole du noyau atomique
A : nombre de masse représentant le nombre de nucléons
Z : numéro atomique représentant le nombre de protons
Doc.2 - modèle du nuage électronique
Caractéristiques des nucléons et de l'électron
| $$\text { particule }$$ | $$\text { proton }$$ | $$\text { neutron}$$ | $$\text { électron }$$ |
| $$\text { symbole }$$ | $$p$$ | $$\text { n }$$ | $$e^{-}$$ |
| $$\text { Masse }(\mathrm{kg})$$ | $$m_{p}=1,673.10^{-27}$$ | $$m_{n}=1,675.10^{-27}$$ | $$m_{0}=9.109 .10^{-31}$$ |
| $$\text { Charge (C) }$$ | $$+e=1,602 \cdot 10^{-19}$$ | $$0$$ | $$-e=-1,602 \cdot 10^{-19}$$ |
NB : le nombre de neutrons $N$ est donné par la relation $N=A-Z$
Masse du noyau
$$M_{\text {noyau }}=Z \cdot m_{p}+(A-Z) \cdot m_{n}$$
Charge du noyau
$$\mathrm{Q}_{\text {noyau }}=+Z . \mathrm{e}$$
Dimension du noyau
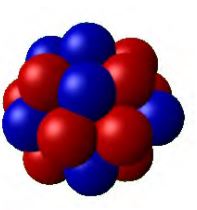
Le noyau atomique est de forme sphérique, son rayon est quelques femtomètre $$(\mathrm{fm})$$.
$$1 \mathrm{fm}=10^{-15} \mathrm{~m}$$
Doc.3 - représentation imagée du noyau
Les électrons
L'électron est une particule chargée négativement. Elle possède une masse $m_{e}=9,109.10^{-31} \mathrm{~kg}$ et une charge $-e=-1,602 \cdot 10^{-19} \mathrm{C}$.
Dimensions de l'atome
L'atome est essentiellement constitué de vide. Il est constitué d'un noyau de taille négligeable par rapport à celle de l'atome.
L'atome est électriquement neutre car il possède autant d'électrons que de protons:
$$\mathrm{Q}_{\text {atome }}=+\text { Z.e }+(-Z . e)=0$$
$$\frac{r(\text { atome })}{r(\text { noyau })}=\frac{10^{-10}}{10^{-15}}=10^{5}$$
Masse de l'atome
La masse de l'atome est la somme des masses de ses constituants :
$m($ atome $=Z \cdot m($ protons $)+(A-Z) \cdot m($ neutrons $+m$ (électrons $)$
Le nuage électronique
Les électrons en mouvement dans la sphère atomique forment le nuage électronique de l'atome.
Dans un modèle simplifié, les électrons se répartissent sur des couches électroniques notés $\mathrm{K}, \mathrm{L}, \mathrm{M}$, etc
Chaque couche électronique ne peut contenir qu'un nombre limité d'électrons, qui varie selon la couche :
| $$\text { couche }$$ | $$\mathrm{K}$$ | $$L$$ | $$\mathrm{M}$$ |
| $$\text { Nombre maximal d'électrons de la couche }$$ | $$2$$ | $$8$$ | $$18$$ |
Une couche est dite saturée lorsqu'elle contient son nombre maximale d'électrons.
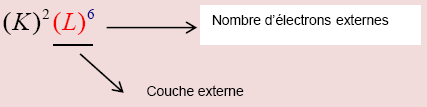
La couche externe est la dernière couche remplie la plus éloignée du noyau. Les autres sont appelées couches internes.
Règle de remplissage
Pour obtenir la structure électronique d'un atome, il faut compter le nombre d'électrons à répartir dans les différentes couches électroniques. La répartition des électrons s'effectue en respectant une règle de remplissage bien précise :
Les couches électroniques sont remplies dans l'ordre suivant : $K$, puis $L$, puis $M$. lorsqu'une couche est saturée, les électrons restants sont placés dans la couche suivante, et ainsi de suite. Cette règle est valable pour un nombre maximal de 18 électrons.
- Structure électronique:
Donner la structure électronique d'un atome, c'est indiquer le nombre d'électrons sur chaque couche. Cette structure électronique s'exprime en plaçant entre parenthèses la lettre indiquant la couche, et en exposant le nombre d'électrons s'y trouvant.
Doc.4 - Le physicien danois Niels Bohr (1885 - 1962) fut le premier à proposer le modèle ou les électrons se situent sur différentes couches électroniques
مثال
Donner la structure électronique de l'oxygène : ${ }_{8} O$
L'élément chimique
لمواصلة هذا الملخص، قم بالتسجيل بالمجان في كيزاكو

- ملخصات الدروس غير محدودة
- فيديو مجاني في كل درس
- تمرين مصحح مجاني
- اختبار تفاعلي