Synthèse d'un ester à partir d'un anhydride d'acide
Anhydride d'acide
Un anhydride d'acide est un composé organique qui possède le groupe caractéristique anhydride
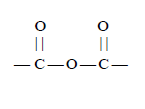
Il résulte de l'élimination d'une molécule d'eau entre 2 molécules d'acide carboxyliques:
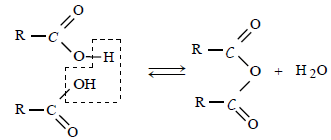
Un anhydride d'acide se nomme en remplaçant le mot acide par le mot anhydride :
$\mathrm{CH}_3-\mathrm{CO}-\mathrm{O}-\mathrm{CO}-\mathrm{CH}_3\left\langle\mathrm{ou}\left(\mathrm{CH}_3 \mathrm{CO}\right)_2 \mathrm{O}\right\rangle$ : Anhydride d'éthanoïque
$\mathrm{CH}_3-\mathrm{CO}-\mathrm{O}-\mathrm{CO}-\mathrm{C}_2 \mathrm{H}_5$ : Anhydride d'éthanoïque et propanoïque
Synthèse de l'ester
$(\mathrm{RCO})_2 \mathrm{O}+\mathrm{R}^{\prime} \mathrm{OH} \longrightarrow \mathrm{R}-\mathrm{COO}-\mathrm{R}^{\prime}+\mathrm{RCOOH}$
Anhydride d'acide Alcool Ester Acide carboxylique
$\left(\mathrm{CH}_3 \mathrm{CO}\right)_2 \mathrm{O}+\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH} \quad \longrightarrow \mathrm{CH}_3-\mathrm{COO}-\mathrm{C}_2 \mathrm{H}_5+\mathrm{CH}_3 \mathrm{COOH}$
Anhydride d'éthanoïque Éthanol Éthanoate d'éthyle Acide éthanoïque
La réaction d'un anhydride d'acide avec un alcool est rapide et totale.
On peut encore accélérer cette réaction par un chauffage modéré et l'emploi du catalyseur $\mathrm{H}^{+}$.
L'hydrolyse de l'ester n'est pas possible car il n'y a pas d'eau, le milieu est anhydre.
L'absence de l'eau rend impossible la réaction inverse d'hydrolyse de l'ester; c'est la raison pour laquelle $\mathbf{x}_f=\mathbf{x}_{\mathbf{m a x}}$.
Application à la synthèse de l'aspirine
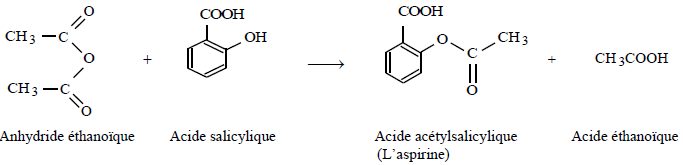
Hydrolyse basique d'un ester ou saponification
L'hydrolyse basique d'un ester ou saponification est la réaction de l'ion $\mathrm{HO}^{-}$, en solution concentrée, avec cet ester ; elle donne un alcool et un ion carboxylate :
$$\mathrm{R}-\mathrm{COO}-\mathrm{R}^{\prime}+\mathrm{HO}^{-} \longrightarrow \mathrm{R}-\mathrm{COO}^{-}+\mathrm{R}^{\prime}-\mathrm{OH}$$
Cette réaction est rapide à chaud et totale.
Les ions $\mathrm{HO}^{-}$sont apportés par la soude ou la potasse.
Exemple : hydrolyse basique du benzoate d'éthyle (le dispositif utilisé est appelé chauffage à reflux)
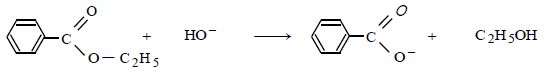
Pour obtenir un précipité d'acide benzoïque, on ajoute au mélange un excès d'acide chlorhydrique :
$$\mathrm{C}_6 \mathrm{H}_5-\mathrm{COO}_{(\mathrm{aq})}^{-}+\mathrm{H}_3 \mathrm{O}_{(\mathrm{aq})}^{+} \longrightarrow \mathrm{C}_6 \mathrm{H}_5-\mathrm{COOH}_{(\mathrm{s})}+\mathrm{H}_2 \mathrm{O}_{(\ell)}$$
Préparation d'un savon par action d'une base forte sur un corps gras
لمواصلة هذا الملخص، قم بالتسجيل بالمجان في كيزاكو

- ملخصات الدروس غير محدودة
- فيديو مجاني في كل درس
- تمرين مصحح مجاني
- اختبار تفاعلي