1. La valeur du quotient de réaction Qr,i dans l’état initial du système chimique.
Equation de la réaction :
Ni(aq)2++Cd(s)⇄Ni(s)+Cd(aq)2+
L’expression du quotient de réaction :
Qr,i=[Ni2+]i[Cd2+]i=CC=1
On a :
Qr,i<K=4,5.105 L’ensemble évolue spontanément dans le sens direct ( sens de formation de Ni et Cd2+
2. Le schéma conventionnel de cette pile.
Au niveau de la cathode se produit la réduction donc l’électrode de 𝑁𝑖 représente le pôle positif de la pile. Le schéma conventionnel est :
(+)Ni(s)/Ni(aq)2+∴Cd(aq)2+/Cd(s)(−)
L’équation de la réaction à chaque électrode :
Au niveau de la cathode (électrode de nickel) se produit la réduction des ions Ni2+:
Ni(aq)2++2e−⇄Ni(s)
Au niveau de l’anode (électrode de cadmium) se produit l’oxydation de Cd(s):
Cd(s)⇄Cd(aq)2++2e−
4. La variation Δm de la masse du nickel pendant Δt:
Tableau d’avancement de la réaction de réduction :

D’après le tableau :
{Δn(Ni)=xn(e−)=2x→Δn(Ni)=2n(e−)→M(Ni)Δm=2FI.Δt→Δm=2FIΔt⋅M(Ni)Δm=2×9,65.1040,3×5×3600×58,7→Δm=1,64g
Partie 2
1. L’équation de la réaction de dosage.
AH(aq)+HO(aq)→A(aq)+H2O(l)
2. Pour obtenir l’équivalence, on doit verser le volume VBE=10mL de la solution SB.
2.1. La concentration CAde la solution S :
D’après la relation d’équivalence :
CA⋅VA=CB⋅VBE d’ouˋ :CA=CB⋅VAVBE
A.N : CA=1010−2×10⇒CA=10−2 mol. L−1
2.2. Montrer que m = 0,5 g.
On a : CA=Vn=M(C9HsO4)⋅Vm alors: m=CA⋅M(C9H8O4)⋅V A.N : m=10−2×180×278.10−3=0,5 g
3. Parmi les indicateurs colorés dans le tableau ci-dessous, l’indicateur convenable à ce dosage.
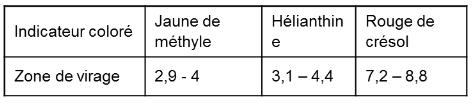
L’indicateur coloré convenable est celui dont la zone de virage contient pHE.
D’après l’équation de la réaction, à l’équivalence, le mélange réactionnel contient les ions A− et l’eau, donc le milieu est basique et son pH>7.