Un transfert thermique, appelé plus communément chaleur, est un transfert d'énergie microscopique désordonnée. Cela correspond en réalité à un transfert d'agitation thermique entre particules, au gré des chocs aléatoires qui se produisent à l'échelle microscopique.
Transfert d’énergie thermique
تعريف
Si on met deux corps à des températures différentes en contact, on constate que la température du corps chaud diminue, alors que celle du corps froid augmente. C’est à dire L’énergie interne du corps chaud décroit, et celle du corps froid croit. Il y a transfert d’énergie entre les deux corps : c’est ce qu’on appelle un transfert thermique noté Q, son unité est le Joule (J).
Sens du transfert thermique
Dans l’expérience citée à la définition, le transfert thermique se fait spontanément du corps ayant la température la plus élevée vers le corps ayant la température la plus basse.
Modes de transfert thermique
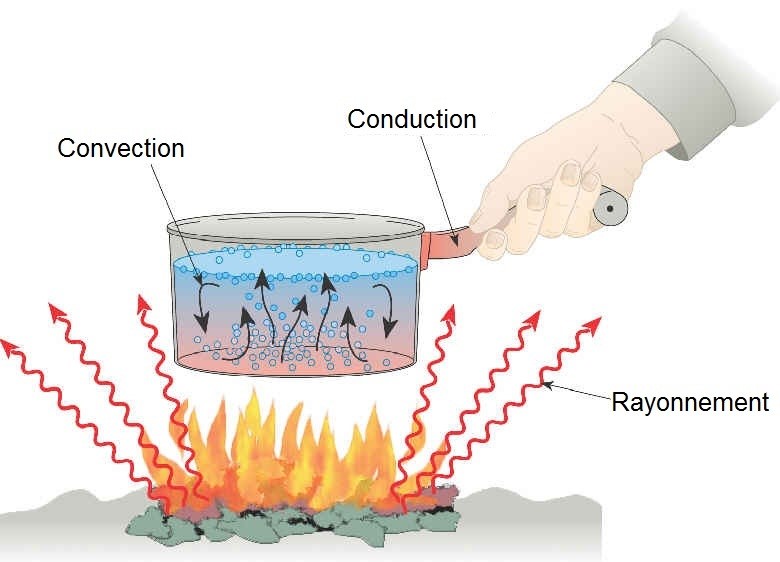
Transfert thermique par conduction
C’est un transfert d’énergie ayant lieu à travers des corps conducteurs thermique sans déplacement de la matière.
مثال
En chauffant l’une des extrémités d’une barre métallique, on constate l’échauffement progressif par conduction le long de la barre.

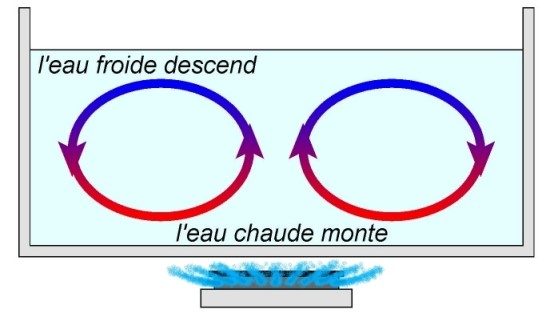
Transfert thermique par convection
C’est un mode de transfert d’énergie avec déplacement de la matière, c’est un déplacement sous forme de courant (air chaud : il s’élève au-dessus de la source chaude)
مثال
Si on fait bouillir de l’eau dans une casserole, l’eau chaude par le fond, se dilate puis monte dans la casserole et l’eau froide descend. Il en résulte un mouvement de convection.
Transfert thermique par rayonnement
Remarque
Tout corps chaud émet des radiations électromagnétiques qui transportent de l’énergie.
- Toute énergie transportée sous forme de radiations électromagnétiques est appelée énergie rayonnante. Elle est notée WR.
- Ce mode de transfert d’énergie peut se faire sur de très grandes distances et même dans le vide
مثال
C’est le cas des ondes électromagnétiques émises par le soleil qui chauffent la terre.

Voilà un exemple qui rassemble toutes les formes de transfert d’énergie thermique :
ما يجب معرفته
Un transfert thermique peut élever la température d’un corps et peut aussi aboutir à un changement d’état physique d’un corps pur.
مثال
Si on chauffe une quantité de l’eau (état liquide), sa température augmente puis lorsqu’on atteint 100°C, il y a un changement d’état
Energie thermique (quantité de chaleur)
تعريف
Energie thermique : C’est la quantité de chaleur Q reçue ou perdue par un corps de masse m lorsque sa température varie de à , qui est donné par la relation :
- Q: énergie thermique en J
- m: la masse du système
- C:la capacité thermique massique du corps en J/Kg.°C
- -: la variation de la température en °Cou en K
- = : capacité thermique en J/°C ou J/K
Conventions
ما يجب معرفته
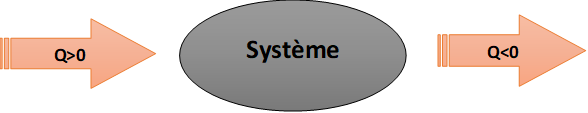
Un système peut recevoir ou céder de l’énergie par transfert thermique avec l’extérieur.
- Si le système reçoit effectivement de l’énergie par transfert thermique, Q sera positive (Q>0)
- Si le système cède effectivement de l’énergie par transfert thermique, Q sera négative (Q<0)
La capacité thermique massique C
La chaleur massique est la quantité de chaleur qu'il faut apporter à 1 kg d'un corps pour en élever la température de 1°C (ou de 1K)
Elle s'exprime en [kJ / kg.°C] ou [kJ / kg.K].
La capacité thermique :
La capacité thermique d’un corps de masse m est la quantité de chaleur qu’il faut lui fournir pour augmenter sa température de 1°C ou 1 K.
On pose : alors la relation devient :
Remarque
La capacité thermique d’un système (S) formé de plusieurs corps est égale à la somme des capacités thermiques de ces corps :
Équilibre thermique
Si on met deux corps à des températures différentes en contact, le transfert thermique se fait de manière spontanée du corps dont la température est plus élevée vers celui dont la température est la plus basse et ce transfert cesse lorsque les deux corps sont à la même température : on dit que l’équilibre thermique est réalisé.
→ Alors l’équilibre thermique se traduit par la relation suivante :
Et dans ce cas : on a
حيلة
Un transfert thermique est souvent accompagné de fuites thermiques (pertes), pour remédier à ce problème, il faut penser à minimiser les fuites en utilisant une enceinte adiabatique (pas d’échange thermique avec le milieu extérieur) qui n’est autre que le calorimètre.

Transfert thermique avec changement d’état physique d’un corps pur (chaleur latente)
لمواصلة هذا الملخص، قم بالتسجيل بالمجان في كيزاكو

- ملخصات الدروس غير محدودة
- فيديو مجاني في كل درس
- تمرين مصحح مجاني
- اختبار تفاعلي