CHIMIE :
Partie I : Dosage acido-basique
1- Coordonnées du point d'équivalence :
VE=10 ml et pHE=6.3
2- A l'équivalence du dosage on a : C⋅V=CA⋅VE
D'où C=VCA⋅VE=102×10−2×10
Soit C=2×10−2 mol.L−1
3- L'indicateur coloré qui convient pour ce dosage est le bleu de bromothymol puisque sa zone de virage contient le pHE: 6<pHE<7.6
4- Equation chimique du dosage:
CH3NH2(aq)+H3O(aq)+⟶CH3NH3(aq)++H2O(ℓ)+
5- * Tableau d'avancement:
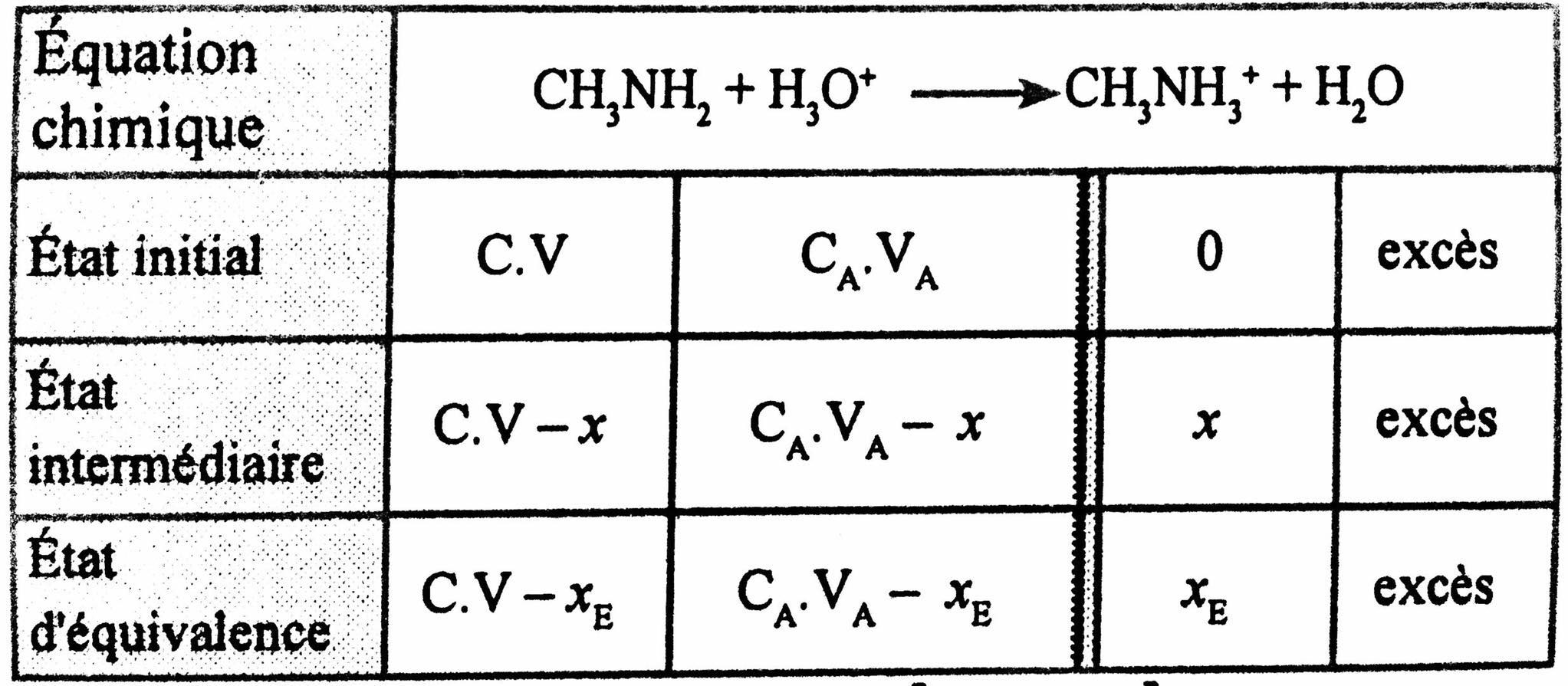
On a la relation : pH=pKA1+log[CH3NH4+][CH3NH2]
Pour : VA<VE et d'aprés le tableau d'avancement :
[CH3NH2]=V+VAC⋅V−x et [CH3NH4+]=V+VAx
Ainsi : pH=pKA1+log(CA⋅VACA⋅VE−1)
pH=pKA1+log(VAVE−1)
On a : y=VEVA
donc VAVE=y1
Donc : pH=pKA1+log(y1−1)
6- Valeur de y :
On a : pH=pKA1+log(y1−1)
Avec : pH=pKA1 cette relation devient :
pKA1+log(y1−1)=pKA1 soit log(y1−1)=0
D'où : y1−1=1 soit y1=2
Donc : y=21=0.5
* Valeur du pKA1 :
On a : y=VEVA=21 soit VA=2VE=5 mL
D'aprés la courbe de la figure 1 ; pKA1, est la valeur du pH pour VA=5 mL :
Soit pKA1=10.55.
7- Etude de la solution (S) dosée :
7-1. Equation de la réaction de la methylamine avec l'eau :
CH3NH2(aq)+H2O⇌CH3NH3(aq)++HO(aq)−
7.2- Taux d'avancement final :
τ=xmaxxf=C×V[HO−]×V=C[HO−]
Avec [HO−]=[H3O+]Ke=10−pHKe
D'où τ=C×10−pHKe=(2×10−2)×10−11.410−11.4
τ=0.125
(Remarque : le pH de cette solution est pH=11. à partir de la courbe de la figure 1).
Conclusion : On a : τ<1 la réaction est limitée.
Partie II : Hydrolyse basique d'un ester
1- Formule semi-développée de l'éthanoate de propyle :
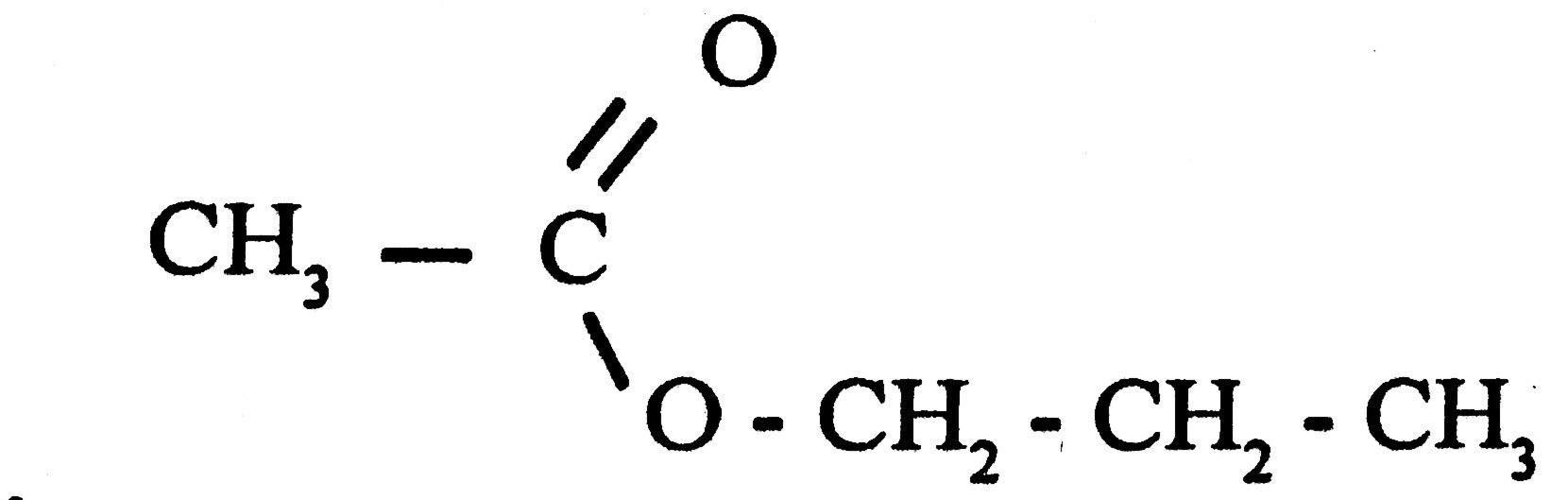
2- Evolution temporelle de cette réaction:
2.1- Le temps t1/2 de demi-réaction est l'abscisse du point qui correspond à la moitié de la valeur maximale de la concentration de CH3COO(aq)−
Graphiquement et par projection on obtient :
t1/2=4,8 min.
2.2-Pour la courbe C′ on a t1/2′≈1,6 min
On a: t1/2<t1/2
On sait que plus la température augmente; la vitesse volumique de réaction augmente et le temps de demi-réaction diminu. Ainsi la courbe C′ correspond à la température θ2
2.3-Vitesse volumique de réaction à t=0 :
On a : V= V1⋅dtdx
D'après l'équation de la réaction on a :
[CH3COO−]=Vx soit x=[CH3COO−]×V
Ainsi : V=dtd[CH3COO−]
D'où : V(t=0)=4−02,2−0=0,55 m mol⋅L−1⋅min−1.
2.4- Quotient de réaction à t1/2 :
Qr=[E]×[HO−][CH3COO−]×[A]
* Tableau d'avancement de la réaction :
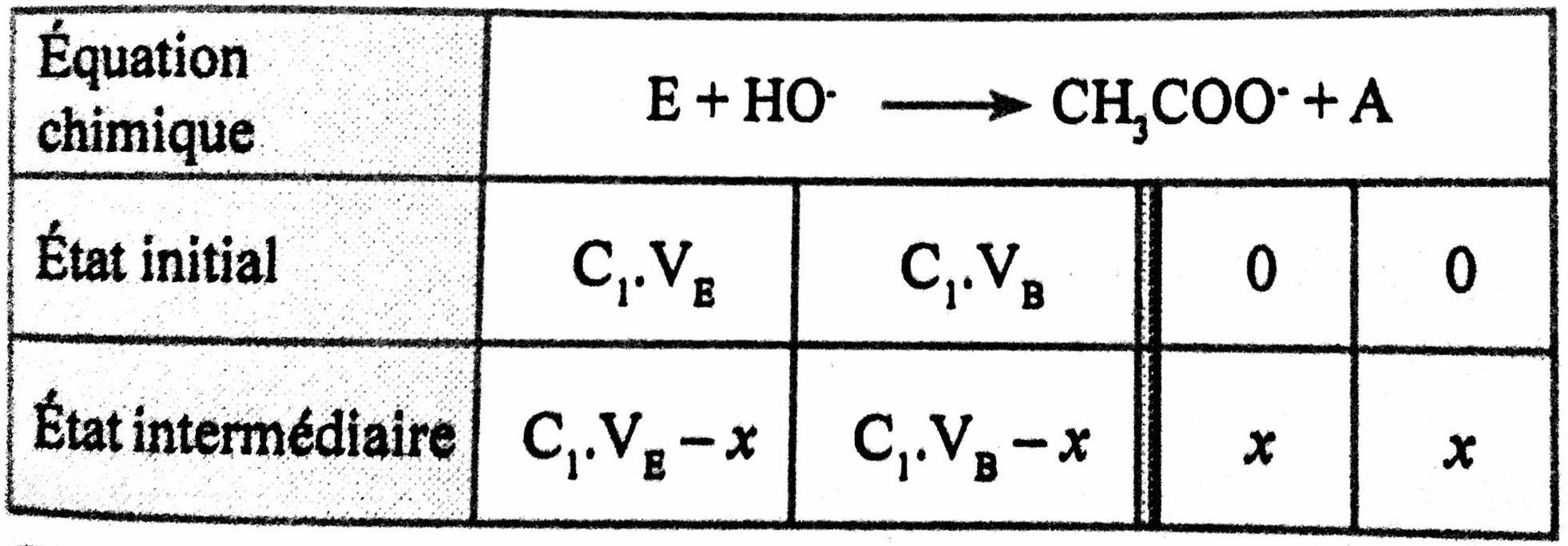
D'après le tableau d'avancement ; On a :
[CH3COO−]=[A]= Vx[E]=[HO−]= VC1⋅VE−x=VC1⋅VE− Vx
Avec: V=VE+VB=2 VE
D’ouˋ: [E]=[HO−]=2 VEC1×VE−[CH3COO−]=2C1−[CH3COO−]
Ainsi : Qr=(2C1−[CH3COO−])2[CH3COO−]2
A t1/2 On a : [CH3COO−]=2×10−3 mol⋅L−1
Qr=(210−2−2×10−3)2(2×10−3)2=0,44
2.5- Rendement de cette réaction :
r=xmaxxf
On a d'après le tableau d'avancement :
[CH3COO−]f= Vxf
soit : xf=[CH3COO−]f×V
C1⋅VE−xmax=0 soit : xmax=C1×VE
D'où : τ=C1×VE[CH3COO−]f×V=C1×VE[CH3COO−]f×2×VE
Donc : τ=C12×[CH3COO−]f
Graphiquement : [CH3COO−]f=4×10−3 mol.L−1
τ=10−22×4×10−3=0,8=80%